Spricht man mit dem Konstanzer Chemiker Michael Przybylski über die Parkinson-Krankheit, wird er schnell sehr grundsätzlich: “Wie kommen diese berühmt-berüchtigten Protein-Aggregate zustande, die sich im Gehirn ablagern?”, fragt er. “Wie entstehen sie chemisch?”
Denn das Muster ist überall das Gleiche, egal ob die Hirnkrankheit nun Parkinson, Alzheimer oder Creutzfeld-Jakob heißt: Es verklumpen Eiweißstoffe (Proteine), die normalerweise nicht verklumpen sollten. Sie bilden Aggregate, die aus 10.000 bis 100.000 gleichen oder ähnlichen Molekülen bestehen. So massiv werden die Ausmaße dieser irregulären Gebilde, dass sie ganze Neuronen-Netzwerke überwuchern. Dabei fallen immer mehr Funktionen aus, auch das Gedächtnis. Zum Glück nicht immer: Bei Parkinson, der sich zunächst durch Bewegungsstörungen oder Schmerzen zeigt, droht nur etwa 30 von 100 Betroffenen mit fortschreitender Krankheit eine Demenz.
Wie kommt es zu solchen Unterschieden? Bisher war die Parkinson-Forschung stillschweigend davon ausgegangen, dass alle Patienten mehr oder weniger dieselbe Sorte Ablagerungen in ihren Gehirnen haben: sogenannte Lewy-Körperchen, benannt nach dem von den Nazis aus Deutschland in die USA vertriebenen Neurologen Friedrich Lewy (1885–1950). Sie bestehen zum Großteil aus einem kleinen, normalerweise löslichen Protein namens Alpha-Synuklein. Es ist 140 Aminosäuren lang.
Gute und böse Aggregate
Aber wahrscheinlich stimmt dieses einfache Bild nicht. “Der Zusammenhang zwischen Demenz und Ablagerung ist nur ungenau und grob”, sagt Michael Przybylski. Das hat sich erst in den vergangenen drei Jahren herausgestellt. Zwei Forschergruppen fanden bei der Analyse der parkinson- typischen Aggregate zwei Sorten: solche, die sehr giftig für die Nerven sind, und andere von geringerer Schädlichkeit. “Wir müssen also davon ausgehen, dass es gute und böse Aggregate gibt”, vereinfacht Przybylski. Und was den Chemiker jetzt brennend interessiert, ist: “Wie sind die genau zusammengesetzt?”
Der Protein-Fahnder hat einen Verdacht: Die bösen Aggregate bestehen womöglich gar nicht aus dem intakten Alpha-Synuklein, sondern aus einem Bruchstück, einem Fragment des Moleküls. Das wäre dann so ähnlich wie bei der Alzheimer-Krankheit, wo es eine schlimmere und eine weniger schlimme Verlaufsform gibt: Bei der schlimmeren ist das auslösende Molekül, das Beta-Amyloid, um zwei Aminosäuren länger als bei der milderen Form. Schuld ist eine Gen-Mutation. Sie sorgt dafür, dass das lange Vorläufermolekül an der falschen Stelle zerschnitten wird.
Bei Parkinson ist der Bösewicht wahrscheinlich ebenfalls ein Spaltprodukt: Das Alpha-Synuklein ist in der Mitte auseinandergebrochen. Das Teilstück, das die Aminosäuren 72 bis 140 enthält, „ist das entscheidende Bruchstück”, sagt Przybylski. Inzwischen sagt er das mit großer Sicherheit. Der Grund dafür sind eine Doktor- und eine Master-Arbeit, die 2010 an seinem Institut enstanden sind: Doktorandin Camelia Vlad hat mit einer besonderen, hochaktuellen Messmethode, der Ionenmobilitäts-Massenspektroskopie, den Kandidaten im Proteingemisch der Hirnzellen genetisch veränderter Mäuse aufgestöbert, die stellvertretend für den Menschen Parkinson-Symptome entwickeln. Sie hat sozusagen “die Nadel im Heuhaufen” gefunden, wie Przybylski es gern vergleicht. Und Kathrin Lindner, die Master-Studentin, hat ein Gen für das Fragment chemisch synthetisiert und dafür gesorgt, dass es in Bakterienzellen abgelesen wird. Auch in diesem künstlichen System zeigte sich, dass das Teilstück ungleich schneller verklumpt als das intakte Alpha-Synuklein.
“Ein wirklicher Durchbruch”
Ihr Betreuer, Professor Przybylski, hat bereits die Konsequenzen aus der Entdeckung gezogen. Er entwickelt zusammen mit der Firma Boehringer Ingelheim einen Hemmstoff, der das Auseinanderbrechen des Alpha-Synukleins verhindern soll. Ein Patent-Antrag ist bereits gestellt. Ließe sich aus diesem Hemmstoff ein wirksames und verträgliches Anti-Parkinson-Medikament entwickeln, dann wäre das “ein wirklicher Durchbruch”, wie Michael Przybylski stolz vermerkt.
An den Forschungen aus Konstanz ist federführend ein Nervenarzt beteiligt: Markus Otto, Professor und Laborleiter an der Universitätsklinik Ulm. Mit dabei ist auch die Baden-Württemberg Stiftung, die das detektivische Duo seit dem Jahr 2007 fördert. Dabei stand im Projektantrag nichts von einem neuen Parkinson-Medikament. Das Ziel war viel bescheidener formuliert: “Neurochemische Marker zu ermitteln, die eine Frühdiagnose der Parkinson-Demenz erlauben, damit solche Patienten zielgerichtet einer Therapie zugeführt werden können.”
Während sein Konstanzer Partner inzwischen zu den molekularen Details der Parkinson-Entstehung vorgedrungen ist, hat Otto den diagnostischen Ansatz konsequent weiterverfolgt: Er hat mit einer Batterie von proteomischen Untersuchungsverfahren nach Unterschieden in der Hirn-Rückenmarksflüssigkeit (dem Liquor) von dementen und nichtdementen Parkinson-Patienten gesucht.
“Proteomik”, das ist eines der Zauberwörter der modernen Biowissenschaften. In einer einzigen Zelle können mehr als 100.000 verschiedene Proteine in unterschiedlichen Mengen vorhanden sein und ihre spezifischen Aufgaben verrichten. Die Analyse-Methoden, mit denen man die einzelnen Eiweiße nicht nur finden, sondern auch ihre Menge bestimmen kann, sind in den letzten Jahren extrem verfeinert worden.
Der Dreifach-Angriff
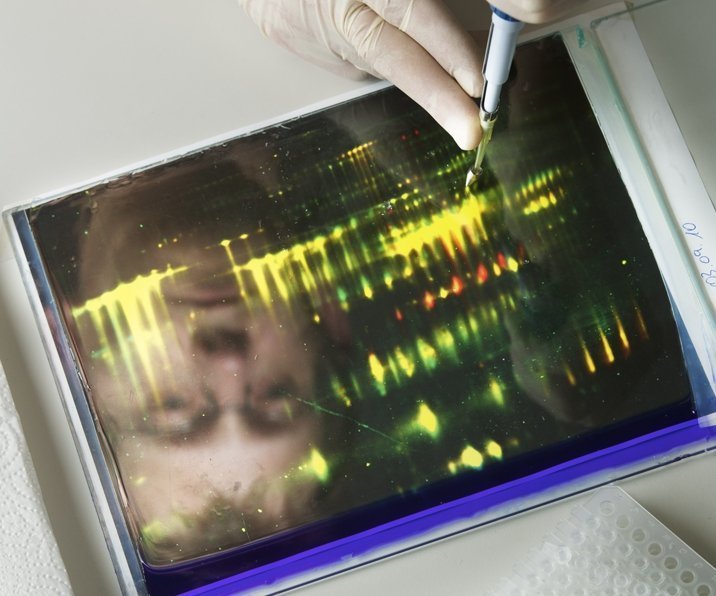
Noch arbeitet man – auch in Ulm – mit der Gel-Elektrophorese: Dabei trennen sich Eiweiße nach ihrer Größe und ihrer Ladung auf einer gel-beschichteten Fläche von 25 mal 20 Zentimeter auf. Sie bilden Flecken, an denen sich die Proteine mit gleichen Eigenschaften sammeln. Aber auch immunologische Trennverfahren, bei denen Antikörper zum Einsatz kommen, haben sich bewährt, um “die Nadel” aus dem “Heuhaufen” herauszufischen. Dabei arbeitet Markus Otto gern mit Kollegen vom Max-Planck-Institut für experimentelle Medizin in Göttingen um Dr. Olaf Jahn und für die “Affinitäts-Proteom-Analytik” mit dem Chemiker Michael Przybylski zusammen. Und zudem stehen die massenspektroskopischen Verfahren zur Verfügung: In diesem Fall wird ein Gerät von Boehringer Ingelheim benutzt. Das verwendete iTRAQ-Verfahren (Isobaric Tags for Related and Absolute Quantitation) erlaubt es, auch Proteine mit sehr ähnlichem Molekulargewicht voneinander zu trennen, indem ihnen unterschiedliche chemische Etiketten (Tags) angeheftet werden.
Kaum zu glauben: Auch in Ulm herrscht aufgeregte Euphorie. Der Dreifach-Angriff auf die Proteine der Parkinson-Patienten mit und ohne Demenz hat einen Kandidaten zutage gefördert, der bei Demenz verändert ist. Viel will Otto noch nicht über die Identität dieses Proteins X verraten, nur so viel: Es ist ein relativ kleines Eiweißmolekül, das womöglich in einer veränderten “Isoform” vorliegt. Es ist anders gefaltet als bei Gesunden oder bei Parkinsonkranken ohne Demenz. Mit der Identifikation von Faktor X, so Markus Otto, hat er nun nicht nur den gesuchten Marker für die Frühdiagnose gefunden. “Wir haben jetzt auch Hinweise auf einen Mechanismus, der bei der Parkinson-Krankheit anders abläuft als bei Gesunden.”
Der Neurologe Otto ist ein Mann, der Herausforderungen nicht scheut. “Man muss sich trauen, im Labor auch einmal etwas in den Sand zu setzen”, sagt er. Ob bei dem teuren Proteomik-Projekt überhaupt etwas Greifbares herauskommen würde, war bei Antragstellung fraglich. Nun sieht es so aus, als hätten sein Partner Przybylski und er gar nichts in den Sand gesetzt, sondern gleich zwei Treffer gelandet, mit denen nicht zu rechnen war.